La FDA, encargada del control de medicinas y alimentos, aprobó la primera vacuna contra el virus respiratorio sincitial (VRS): Arexvy, de GSK (GlaxoSmithKline Biologicals), para personas mayores de 60 años. Además, está en proceso de aprobación otra vacuna para adultos de ese grupo etáreo presentada por Pfizer.
En el caso de los adultos de 65 años o más, los CDC estiman, basándose en varios estudios y en sus propios datos de vigilancia, que se producen entre 60,000 y 160,000 hospitalizaciones anuales por VRS y entre 6,000 y 10,000 muertes.
En esta nota te contamos por qué el VRS se convirtió en motivo de preocupación en Estados Unidos en noviembre de 2022, cuando se produjeron un número inusual de contagios en niños de menos de un año, y aquí repasaremos algunas preguntas habituales sobre el VRS y las posibles vacunas para los adultos mayores.
¿Qué síntomas causa el VRS?
Según los CDC, el VRS provoca síntomas similares a los del resfriado, como secreción nasal, tos, estornudos, fiebre, respiración sibilante y pérdida de apetito. Los bebés menores de 6 meses pueden presentar sólo los síntomas de dificultad para respirar, irritabilidad y reducción de la actividad o del apetito.
El VRS suele ser un virus de clima frío, que circula en otoño e invierno.
A lo largo de la vida, una persona puede volver a infectarse por el VRS “con bastante frecuencia”, dijo la Dra. H. Keipp Talbot, experta en enfermedades infecciosas de la Universidad de Vanderbilt, durante una presentación sobre la inmunidad al VRS ante el Comité Asesor de Vacunas y Productos Biológicos Relacionados (VRBPAC, para abreviar) de la FDA el 28 de febrero de 2023. El comité se reunió durante 2 días para debatir 2 vacunas candidatas para adultos mayores.
La inmunidad adquirida tras una infección “no proporciona una protección duradera o completa frente a la reinfección”, concluyó Talbot, que también es miembro de un comité asesor de los CDC, tras explicar las investigaciones de varios estudios. Puede producirse otro caso de VRS en los 2 meses siguientes a la última infección de una persona.
Para la mayoría de las personas, la enfermedad es leve y la recuperación ocurre en un plazo de 2 semanas. Pero los bebés y los adultos mayores corren mayor riesgo de contraer una infección grave y requerir hospitalización, sobre todo los que padecen enfermedades cardíacas y pulmonares, los que tienen el sistema inmunitario debilitado o son bebés prematuros o pequeños.
De hecho, a finales de 2022, un aumento repentino de infecciones por el VRS superó la capacidad de los hospitales infantiles de todo el país, por lo que puede que la enfermedad, y encontrar una forma de prevenirla, sea una prioridad para muchos padres de niños pequeños. Pero la búsqueda de una vacuna segura y eficaz lleva décadas, y las recientes prometedoras candidatas se deben a un avance científico en la investigación de cómo el virus infecta las células.
Schaffner dijo a FactCheck.org, medio aliado de Factchequeado, que hace falta mucha educación sobre el virus y que esto es especialmente cierto en el caso de los riesgos para los adultos mayores. Dijo que a la gran mayoría de los médicos que atienden a adultos mayores se les enseñó que el VSR es un virus pediátrico, y que la información sobre el impacto en la población de adultos mayores se generó en los últimos 10 a 15 años.
En el caso de los adultos de 65 años o más, los CDC estiman, basándose en varios estudios y en sus propios datos de vigilancia, que se producen entre 60,000 y 160,000 hospitalizaciones anuales por VRS y entre 6,000 y 10,000 muertes. Fiona Havers, jefa del equipo de vigilancia de hospitalizaciones por coronavirus y enfermedades respiratorias de los CDC, presentó estos datos en la reunión del VRBPAC celebrada el 28 de febrero de este año, donde señaló que los amplios intervalos muestran que existe una “incertidumbre sustancial” sobre la carga de la enfermedad, y que los intervalos superiores podrían ser mayores porque las pruebas de VRS no se realizan con frecuencia.
En comparación, la gripe está relacionada con entre 128,000 y 467,000 hospitalizaciones y entre 16,000 y 43,000 muertes al año entre los adultos mayores de 65 años, según los CDC.
Schaffner dijo que no existe una prueba de VRS “rápida, precisa y relativamente económica” que pueda utilizarse en las consultas médicas. Las pruebas se realizan principalmente en estudios de investigación y en hospitales, donde son caras y forman parte de una prueba que busca varios virus a la vez.
Havers señaló que las personas de 80 años o más presentan tasas mucho más elevadas de hospitalización por el VRS, de 237 a 325 hospitalizaciones por cada 100,000 personas, de 3 a casi 4 veces superiores a las tasas de las personas de 65 a 69 años, según los datos de los CDC que se basan en información de una red de hospitales de 12 estados.
¿Cuándo se desarrolló la vacuna?
Los científicos llevan décadas trabajando en vacunas contra el VRS. En la década de 1960, un ensayo clínico que probaba una vacuna contra el VRS para bebés lactantes elaborada con virus inactivados (el mismo método utilizado para las vacunas contra la gripe y la hepatitis A) descubrió que esta no detenía las infecciones y que en las personas que recibían la vacuna, cuando luego contraían VRS, la enfermedad era más grave que en los lactantes del grupo de control. Dos bebés de 14 y 16 meses fallecieron.
No fue hasta una investigación científica publicada en la revista Science en 2013 que las perspectivas de vacunas viables contra el VRS cambiaron considerablemente. Un equipo de científicos del Instituto Nacional de Alergias y Enfermedades Infecciosas (NIAID, por sus siglas en inglés), que forma parte de los Institutos Nacionales de Salud (NIH, por sus siglas en inglés), logró estabilizar la configuración de la proteína F del virus (la proteína que el virus utiliza para entrar en las células humanas) antes de la fusión (prefusión) y determinó mediante ensayos en animales que la inmunización con variantes de la forma prefusión de la proteína F desencadenaba respuestas de anticuerpos altamente protectoras.
Un artículo publicado en Nature en diciembre de 2021 explica que la proteína F cambia su configuración una vez que se fusiona con las células a una forma posterior a la fusión (posfusión). Sin embargo, los investigadores señalaron en su estudio de 2013 que si se atacaba la forma prefusión, que es menos estable, en lugar de la forma posfusión, se producían mayores respuestas de anticuerpos.
¿Cuáles son las posibles vacunas para los adultos mayores?
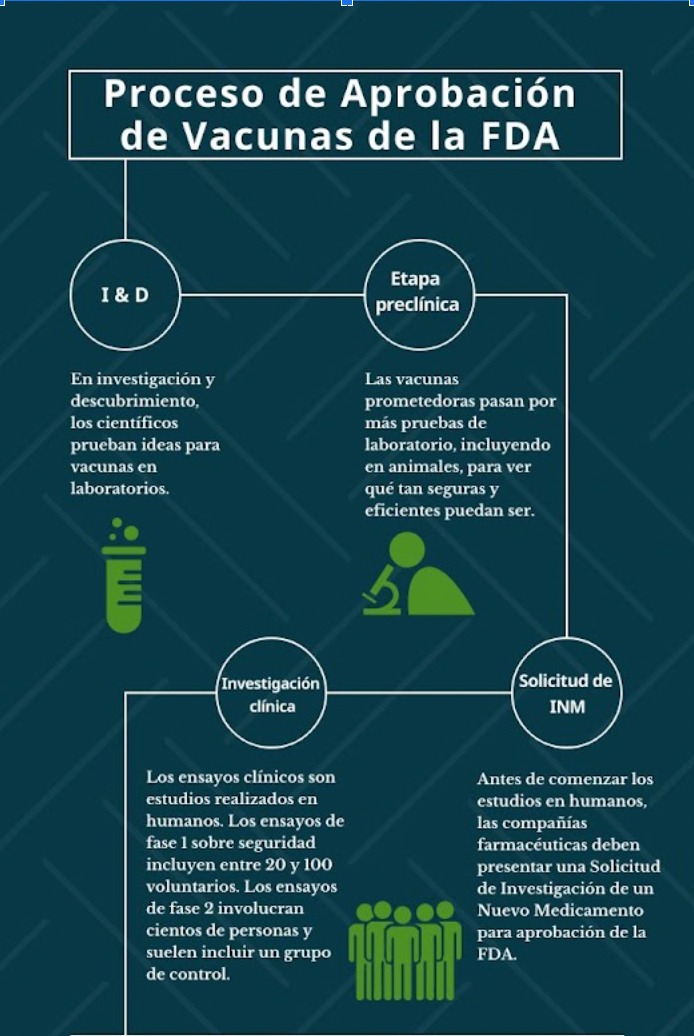

Pfizer y GSK presentaron a la FDA solicitudes para sus vacunas candidatas contra el VRS para adultos mayores de 60 años. La de GSK, llamada Arexvy, fue aprobada el 3 de mayo de este año. Estas fueron las 2 vacunas discutidas en las reuniones del 28 de febrero y el 1 de marzo de 2023 del Comité Asesor de Vacunas y Productos Biológicos Relacionados de la FDA.
Ambas son vacunas de subunidades proteicas, lo que significa que se producen a partir de sólo una parte del virus, en este caso la forma prefusión de la proteína F estabilizada del VRS, la cual provoca una respuesta inmunitaria, pero no puede causar la enfermedad por el VRS. Las vacunas contra la hepatitis B y la tos ferina se fabrican del mismo modo.
La vacuna de Pfizer, denominada Abrysvo, emplea la proteína F en la configuración prefusión de los VRS-A y VRS-B, subgrupos del virus. La vacuna Arexvy combina la configuración prefusión de la proteína F del VRS-A con un adyuvante, una sustancia que puede potenciar la respuesta inmunitaria del organismo a la proteína F. El adyuvante de la vacuna candidata contra el VRS es el mismo, aunque en menor cantidad, que el utilizado en Shingrix, la vacuna contra el herpes zóster también producida por GSK.
Pfizer probó inicialmente la adición de un adyuvante, pero no encontró “ningún beneficio sustancial” en la respuesta inmunitaria al incluirlo, dijo Gurtman.
Moderna también está trabajando en una vacuna candidata contra el VRS para adultos mayores, utilizando tecnología de ARNm, la misma que se emplea en las vacunas contra el COVID-19 de Moderna y Pfizer/BioNTech, para que las células produzcan la forma prefusión de la proteína F estabilizada a fin de desencadenar una respuesta inmunitaria. Moderna ha dicho que presentará una solicitud a la FDA en el primer semestre de este año.
¿Qué sabemos de la eficacia?
Nos centraremos en la vacuna de GSK, que fue recién aprobada. La eficacia es la reducción relativa de la enfermedad en un ensayo clínico entre los grupos de vacunados y de placebo. Representa un menor riesgo de contraer la enfermedad si la persona se vacuna.
GSK dijo a FactCheck.org, medio aliado de Factchequeado, que espera tener datos sobre la segunda temporada de VRS en el hemisferio norte en el tercer cuarto de este año.
Los datos de eficacia del ensayo de fase 3 de GSK, que se han publicado en el New England Journal of Medicine, mostraron una eficacia de la vacuna del 82.6% en la prevención de la enfermedad de las vías respiratorias bajas por VRS confirmada en adultos de 60 años o más, con 7 casos en el grupo de la vacuna y 40 en el grupo del placebo. La eficacia contra la enfermedad grave fue del 94.1%, con un caso en el grupo de la vacuna y 17, en el del placebo.
En el ensayo, que comenzó en 2021, participaron casi 25,000 personas en 17 países, la mitad de las cuales recibieron la vacuna y el resto, un placebo. Alrededor del 40% de los participantes eran considerados “frágiles” o “prefrágiles”, según una prueba de velocidad de la marcha, alrededor del 95% tenía al menos una comorbilidad y alrededor del 40% tenía una “comorbilidad de interés” asociada a la enfermedad grave por el VRS.
La eficacia en la prevención de la enfermedad de las vías respiratorias bajas por el VRS confirmada en esa población de interés fue del 94.6%, con un caso en el grupo de la vacuna y 18 en el del placebo, pero hubo muy pocos casos en la población frágil para determinar la eficacia en ese grupo.
¿Qué muestran los datos de seguridad de la vacuna de GSK?
La empresa dijo que los datos muestran que la vacuna fue “bien tolerada” y tuvo un “perfil de seguridad aceptable”. El dolor en el lugar de la inyección fue el efecto secundario más frecuente; casi el 61% de un subgrupo de participantes a los que se pidió esa información notificó dolor en el lugar de la inyección. El cansancio, los dolores musculares, el dolor de cabeza y la rigidez articular también se notificaron en porcentajes superiores a los del grupo placebo.
No hubo diferencias significativas en el número de muertes entre los grupos de la vacuna y el placebo.
Hubo un caso de síndrome de Guillain-Barré 9 días después de la vacunación, que la FDA y el investigador del estudio consideraron que estaba “relacionado con la vacunación”, según el documento informativo de la FDA sobre la vacuna. Eso supondría una tasa de 1 de cada 15,000 personas. Y en un ensayo de fase 3 más pequeño, de 890 participantes, que estudiaba la administración conjunta con la vacuna antigripal, 2 participantes de 71 años presentaron encefalomielitis aguda diseminada o ADEM (por sus siglas en inglés), un trastorno neurológico que implica inflamación del cerebro y la médula espinal.
En uno de esos casos, un hombre presentó síntomas 7 días después de la vacunación y posteriormente falleció. El otro caso fue el de una mujer que presentó síntomas 22 días después de la vacunación y se recuperó. El investigador del estudio dijo que los casos estaban “posiblemente relacionados” con la vacuna antigripal, y la FDA los consideró “posiblemente relacionados” con la vacuna antigripal o con la vacuna de GSK.
También hubo diferencias significativas en la fibrilación auricular (una arritmia causada por un problema en el sistema eléctrico del corazón) en los 30 días siguientes a la vacunación, con 10 casos en el grupo de la vacuna y cuatro, en el del placebo. Peggy Webster, vicepresidenta y responsable de seguridad de vacunas de GSK, dijo durante la reunión del VRBPAC que 6 de los casos del grupo de la vacuna y 2 del placebo se dieron en personas con antecedentes de esta afección.
La FDA y el investigador del estudio consideraron otros 6 casos de posibles enfermedades inmunomediadas que podrían estar relacionadas con la vacuna: gota, pancitopenia, parálisis de Bell, psoriasis y enfermedad de Graves. También hubo un caso de gota en el estudio de administración conjunta, posiblemente relacionado con la vacuna antigripal o contra el VRS de GSK, según la FDA.
La FDA dijo que en el estudio de administración conjunta “no hay pruebas de interferencia en las respuestas inmunitarias” a la vacuna antigripal y a la de GSK.
¿Quién recibiría la vacuna y con qué frecuencia?
Es demasiado pronto para decirlo. Los ensayos clínicos de Pfizer y GSK aún no disponen de datos de una segunda temporada de VRS para responder a la pregunta sobre cuánto tiempo la vacunación proporcionaría protección, aunque los miembros del VRBPAC hablaron de la posibilidad de que fuera una vacuna anual, como la de la gripe.
Una vez que la FDA aprueba el uso de las vacunas, los CDC, basándose en las recomendaciones de su Comité Asesor sobre Prácticas de Vacunación (ACIP, por sus siglas en inglés), publican directrices sobre quién debe vacunarse y con qué frecuencia. Sin embargo, los “grupos de trabajo” sobre el VRS, que incluyen a miembros del ACIP, presentaron los datos disponibles sobre las vacunas de Pfizer y GSK e información sobre el VRS en una reunión del ACIP celebrada a finales de febrero. Los grupos de trabajo hacen recomendaciones a todo el ACIP, pero luego no votan sobre las pautas finales.
La opinión mayoritaria del grupo de trabajo sobre el VRS en adultos fue que ambas vacunas deberían recomendarse a los mayores de 65 años, pero no a los de 60 a 64 años. Además, según el Michael Melgar, director del grupo de trabajo sobre el VRS en adultos de los CDC, existe la “opinión minoritaria sustancial” de no recomendar las vacunas basándose en los datos disponibles, debido a la preocupación por el equilibrio entre los riesgos y los beneficios y la “subrepresentación” en los ensayos de adultos mayores de 80 años que corren un mayor riesgo de sufrir una enfermedad grave por el VRS.
Una portavoz de los CDC, Katherina Grusich, dijo a FactCheck.org, medio aliado de Factchequeado, en un correo electrónico que “no se votó” en la reunión de febrero del ACIP, “pero el debate, que incluyó una sólida deliberación sobre los datos disponibles de seguridad, costo y eficacia, y las posibles consideraciones clínicas, ayudarán a informar las futuras recomendaciones de políticas del ACIP” si la FDA aprueba las vacunas.
Traducido por Claudia Cohen.
Este artículo ha sido publicado en Factchequeado gracias a nuestra alianza con FactCheck.org. Súmate y verifica los contenidos que recibes enviándolos a nuestro WhatsApp +16468736087 o a factchequeado.com/whatsapp.
Leer más:
Qué sabemos del virus respiratorio sincitial o VRS y por qué debemos tener más cuidado con los niños
Cómo mantenerte al día con las vacunas del COVID-19 y la gripe