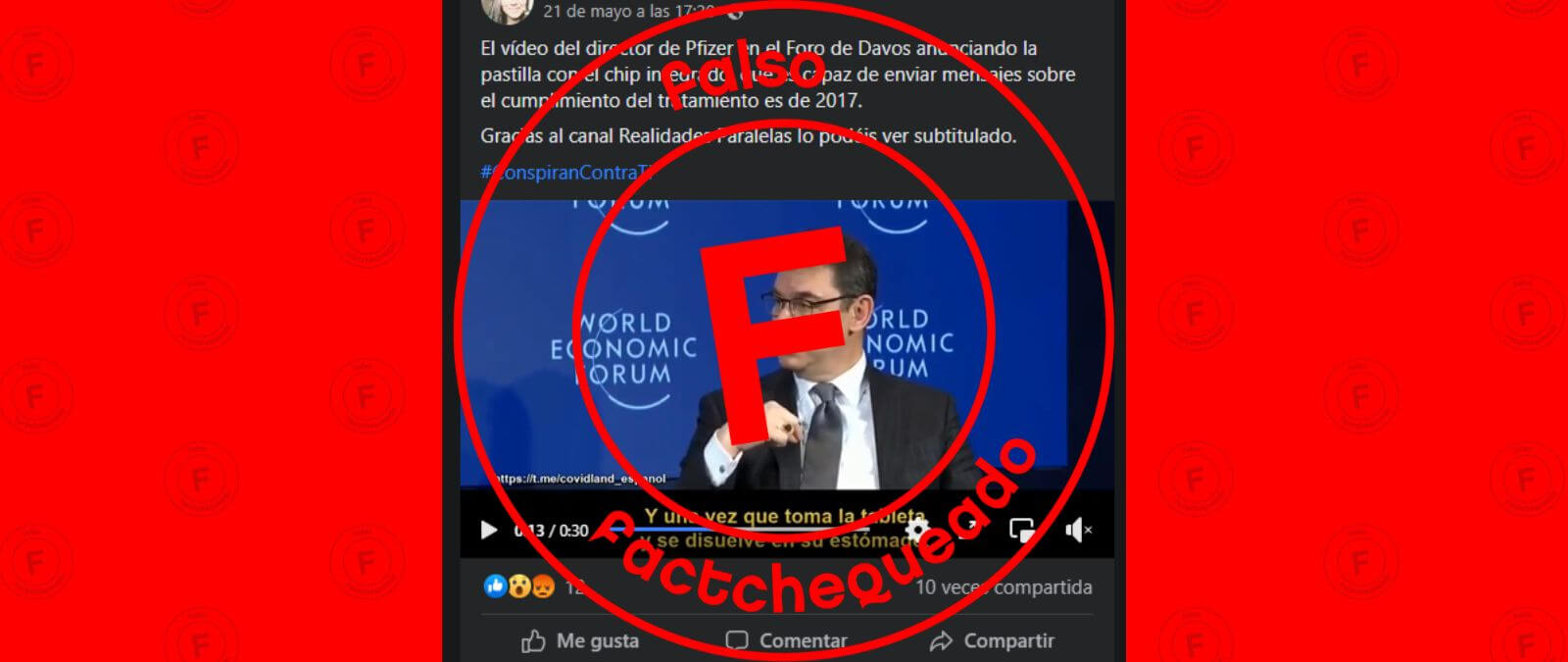
Circula en el extracto de un video de una conferencia que asegura: “El CEO de Pfizer, Albert Bourla, explica la nueva tecnología de Pfizer a la multitud de Davos: ‘píldoras ingeribles’, una píldora con un pequeño chip que envía una señal inalámbrica a las autoridades pertinentes cuando se ha digerido el producto farmacéutico. ‘Imagínese el cumplimiento’, proclama con orgullo”. Sin embargo, esto es falso.
Albert Bourla, presidente y CEO de Pfizer en el video viral expresa: “La FDA [La Administración de Alimentos y Medicamentos de Estados Unidos] aprobó la primera píldora electrónica, si puedo llamarla de esa manera. Es básicamente un chip biológico que está en la tableta y una vez que tomas la píldora y se disuelve en tu estómago, envía una señal indicando que la tomaste. Imaginen las aplicaciones de eso, el cumplimiento. Las compañías de seguros sabrán que los pacientes toman los medicamentos que deberían tomar”.
El video original de la participación de Bourla en el Foro Económico Mundial fue publicado el 25 de enero de 2018, cuando entonces ocupaba el carago de director de operaciones de Pfizer (COO) durante el foro “Transformando la Salud en la Cuarta Revolución Industrial”.
La cita responde a una pregunta de uno de los allí presentes: “Incluso si crean la mejor medicina o el mejor dispositivo, no hay garantía de que el paciente vaya a tomarla o a ponérselo, ¿cómo tienen pensado que la tecnología haga participar al paciente?”.
Y si bien Bourla responde con el fragmento viralizado sobre la “primera píldora electrónica” aprobada por la FDA de Estados Unidos, no fue desarrollada por Pfizer sino por las empresas Otsuka Pharmaceutical y Proteus Digital Health.
Tal como afirma el sitio de fact-checking en español AFP Factual, ambas compañías desarrollaron Abilify MyCite, pastillas de aripiprazol, un antipsicótico que es el primer fármaco en Estados Unidos con un sistema de seguimiento de ingestión digital que contiene un sensor ingerible que registra si el medicamento fue digerido.
Un comunicado publicado por la FDA el 13 de noviembre de 2017 señala: “El producto está aprobado para el tratamiento de la esquizofrenia, el tratamiento agudo de episodios maníacos y mixtos asociados con el trastorno bipolar I y para su uso como tratamiento adicional para la depresión en adultos”.
Contrariamente a lo que afirma la publicación viral, el comunicado detalla que el sistema funciona enviando un mensaje desde el sensor de la píldora a un parche portátil. El parche transmite la información a una aplicación móvil para que los pacientes puedan rastrear la ingestión del medicamento en su teléfono inteligente. Los pacientes también pueden permitir que sus cuidadores y médicos accedan a la información a través de un portal web, asegura la FDA.
El organismo advierte que el fármaco Abilify MyCite no tiene que usarse para rastrear la ingestión de drogas en "tiempo real" o durante una emergencia porque la detección puede retrasarse o no ocurrir.
Abilify fue aprobado por primera vez por la FDA en 2002 para tratar la esquizofrenia. La FDA autorizó por primera vez la comercialización del sensor ingerible utilizado en Abilify MyCite en 2012.